Jakarta - Larutan elektrolit dan larutan non-elektrolit adalah sifat larutan berdasarkan daya hantar listriknya. Show
Larutan elektrolit adalah larutan yang zatnya mampu menghantarkan arus listrik ketika dilarutkan dalam air, sedangkan larutan non-elektrolit adalah larutan yang zatnya tidak dapat menghantarkan arus listrik. Mengapa larutan non-elektrolit tidak bisa menghantarkan listrik, sedangkan larutan elektrolit bisa? Ilmuwan asal Swedia bernama Svante August Arrhenius, pada tahun 1887 menjelaskan tentang peristiwa hantaran arus listrik melalui larutan dengan teori ionisasi. Berdasarkan Arrhenius, larutan elektrolit dapat menghantarkan listrik karena di dalamnya mengandung ion-ion, yang dapat bergerak bebas. Ion-ion itu lah yang berfungsi sebagai penghantar arus listrik dalam larutan, seperti dikutip dalam modul Guru Pembelajar Keahlian Kimia Kesehatan oleh Eti Suherti. Oleh sebab itu, banyak sedikitnya ion yang terjadi pada ionisasi merupakan penentu dari besarnya daya hantar listrik yang terkandung pada larutan elektrolit. Semakin banyak ion dalam larutan, maka daya hantar listriknya akan semakin kuat. Dimana hal tersebut tidak lah bisa ditemukan pada larutan non-elektrolit. Untuk lebih jelasnya, simak perbedaan larutan elektrolit dan larutan non-elektrolit di bawah ini ya! Larutan ElektrolitLarutan elektrolit bisa disebut juga dengan konduktor elektrik. Jenis larutan ini ada yang sifatnya kuat dan lemah. Ciri-ciri larutan elektrolit adalah :
Contoh larutan elektrolit kuat: Basa = KOH, NaOH, radium (Ra), dan basa dari golongan I A dan II A lainya (kecuali Be(OH)₂ dan Mg(OH)₂)Asam = HCI, HBr, HI, HNO₃, HCIO₃, HCIO₄ Garam = NaCI, K₂SO₄, CaCI₂, AICI₃ Larutan elektrolit lemah adalah larutan yang masih bisa menghantarkan listrik, tapi sifatnya lemah sehingga lampu tidak terlalu bisa menyala dengan terang. Ciri-ciri larutan elektrolit lemah:
Contoh larutan elektrolit lemah: Basa = Be(OH)₂, Mg(OH)₂, dan beberapa basa dari logam transisi. Larutan Non ElektrolitSeperti namanya, larutan non-elektrolit adalah larutan yang tidak dapat menghantarkan arus listrik. Jika disekitar penghantar listrik (electrode) tidak muncul gelembung-gelembung gas, dan lampu tidak menyala ketika diuji. Ciri-ciri dari larutan non-elektrolit:
Contoh larutan non-elektrolit diantaranya: Sukrosa (C₁₂H₂₂O₁₁)Glukosa (C₆H₁₂O₆)Urea (CO(NH2)2), Larutan etanol (C2H5OH) Vitamin C. Jenis Ikatan dalam Senyawa Elektrolit dan Non-elektrolitSenyawa akan terbentuk apabila suatu unsur saling berikatan dengan satu sama lain. Cara unsur-unsur yang berikatan dalam membentuk suatu molekul berbeda-beda, yang akan dipengaruhi oleh sifat-sifatnya. Melansir modul Kimia Paket C Setara SMA/MA karya Mia Rahmi Fauziah, jika ditinjau dari ikatannya, senyawa termasuk elektrolit yang terbentuk dari adanya ikatan ion dan ikovalen polar, sedangkan senyawa yang terbentuk dengan ikatan kovalen non-polar adalah termasuk dalam larutan non-elektrolit. 1. Senyawa ion Senyawa ion adalah senyawa yang memiliki ion (meliputi basa dan garam), contohnya adalah NaCl. NaCi terbentuk dari ion Na+ dan ion Cl-. Ikatan ini terbentuk oleh atom logam dan atom non logam. Senyawa ion yang dilarutkan atau dilekehkan dalam air, akan mengalami ionisasi sempurna sehingga termasuk elektrolit kuat. Ion-ion NaCl dalam wujud padatnya tidak dapat bergerak bebas, sehingga tidak bisa menghantarkan listrik. Namun, apabila senyawa ion ini dilarutkan, maka ion-nya mampu bergerak bebas sehingga bisa menghantarkan listrik. 2. Senyawa Kovalen Senyawa kovalen terdiri dari molekul-molekul yang memiliki sifat netral dan tidak dapat menghantarkan listrik. Namun, mengapa pada senyawa kovalen HCl mampu menghantarkan listrik? Senyawa kovalen bersifat polar yang terdapat gaya tarik menarik untuk memutuskan ikatan-ikatan tertentu antar molekul. Sehingga, jika dilarutkan dalam air (pelarut polar) akan mengalami ionisasi yang bisa menghantarkan listrik. Hanya larutan senyawa kovalen polar saja yang dapat menghantarkan listrik, sedangkan senyawa kovalen non-polar tidak. Nah, itu tadi penjelasan mengenai larutan elektrolit dan larutan non-elektrolit. Semoga detikers jadi lebih paham ya! Simak Video "Fakta-fakta dari Ledakan Pabrik Kimia di Cilegon" (pal/pal)
Top 1: manakah konduktor yang lebih baik? jelaskana. HCI 0,1 M atau ... - Brainly. Top 1: manakah konduktor yang lebih baik? jelaskana. HCI 0,1 M atau ... - Brainly
Pengarang: brainly.co.id - Peringkat 107 Ringkasan: . tolong bantu jawab soal kimia berikut . halo tolong dibantu dgn cara yaa, terima kasih . Setarakan reaksi berikut ini (dengan cara aljabar) NaOH + H2S → Na2S + H2O . Tuliskanlah reaksi contoh reaksi redoks yang berlangsung cepat dan berlangsung lambatplis tolong di jawab . Tuliskan persamaan reaksi kimia setara dari reaksi-reaksi berikut! A. Larutan perak nitrat direaksikan dengan larutan kalium klorida menghasilkan en. … dapan perak k Hasil pencarian yang cocok: b.Yang lebih baik adalah HCl 0,1 M karena HCl merupakan elektrolit kuat sehingga menjadi konduktor yang lebih baik daripada CH3COOH yang merupakan elektrolit ... ... Top 2: Manakah konduktor yang lebih baik ? Jelaskan. (A) HCl 0,1 M ... - Brainly
Pengarang: brainly.co.id - Peringkat 109 Ringkasan: . Tentukan jumlah 6 suku pertama jika diketahui suku pertamanya adalah 20 dan suku kelimanya 240. . help m pleaseeeee ,gausa pAke cara gapapa ini buru2 bangetta). 134b).140c).144d).154 . plis jawab!!!!!!!!!!!! . KPK dan fbp dari 12 dan 32 pakek pohon faktor? . 425:3=kasih penjelasannya dan hasilnya . debit air sebuah sungai 30L / detik apabila volume air yg dialirkan sungai 36m³ maka berapa menit waktu yg diperlukan yg untuk mengal Hasil pencarian yang cocok: b.Yang lebih baik adalah HCl 0,1 M karena HCl merupakan elektrolit kuat sehingga menjadi konduktor yang lebih baik daripada CH3COOH yang ... ... Top 3: Manakah yang merupakan konduktor yang lebih baik? ...
Pengarang: roboguru.ruangguru.com - Peringkat 178 Ringkasan: Konduktor adalah penghantar listrilk. Penghantar listrik adalah suatu material yang mudah menghantarkan arus listrik. Sifat hantarannya adalah memindahkan elektron-elektron dari satu titik kelistrikan ke titik kelistrikan lainnya secara mudah. Kegunaan utama dari penghantar listrik adalah mengalirkan arus listrik. Suatu larutan yang dapat menghantarkan listrik disebut larutan elektrolit. Sifat konduktor ditentukan oleh banyaknya partikel zat yang terlarut. Semakin banyak zat terlarut maka a Hasil pencarian yang cocok: 0,2 M merupakan konduktor yang lebih baik karena molaritasnya lebih besar sehingga semakin banyak partikel zat ion-ion nya. C. Larutan Mg Cl subscript 2 0,1 M ... ... Top 4: Manakah larutan yang menghantarkan listrik lebih b...
Pengarang: roboguru.ruangguru.com - Peringkat 177 Ringkasan: a. HCl 1 M atau HCl 2 M. Untuk zat yang sama, maka kekuatan daya hantar listrik dilihat dari besarnya konsentrasi atau molaritas. Semakin besar konsentrasi semakin banyak ion sehingga semakin kuat menghantarkan listrik. Maka HCl 2 M larutan yang menghantarkan listrik lebih baik. Jadi larutan yang menghantarkan listrik lebih baik adalah larutan 2 M. b. 1 M atau . Pada konsentrasi sama maka HCl merupakan larutan yang menghantarkan listriknya lebih baik. Larutan HCl merupakan larut Hasil pencarian yang cocok: Pertanyaan. Manakah larutan yang menghantarkan listrik lebih baik? Jelaskan! a. HCl 1 M atau HCl 2 M. b. ... Top 5: Top 10 manakah yang dapat menghantarkan listrik lebih baik hcl ...
Pengarang: memperoleh.com - Peringkat 189 Ringkasan: Top 1: manakah konduktor yang lebih baik? jelaskana. HCI 0,1 M atau ... - BrainlyPengarang: brainly.co.id - Peringkat107Ringkasan:. NaOH + k2cr2o7 + c6h12o6 = . a.sayur lodeh. d.asam cukab.sabun cucu cair. e.air cucian Berasc.kuah opor. f.air teh celupkelompok benda yang termasu. … k campuran campuran homogen dan campuran heterogen heterogen dalam senyawa AB3 terkandung massa unsur B sebesar 60% jika direaksikan 32 gram unsur A dan 50 gram unsur B. Tentukan AB3 yang terbentuk dan sisa reak. … Hasil pencarian yang cocok: 6 Apr 2022 — Hasil pencarian yang cocok: 28 Mar 2022 — Manakah konduktor yang lebih baik? jelaskan a. HCI 0,1 M atau HCI 0,2 Mb. HCI 0,1 M atau CH3COOH 0,1 ... ... Top 6: Manakah konduktor yang lebih baik antara hcl 0,1 m atau ... - KUDO.TIPS
Pengarang: kudo.tips - Peringkat 170 Ringkasan: . Baekii. @Baekii March 2019. 1. 38. Report Manakah konduktor yang lebih baik antara hcl 0,1 m atau ch3cooh 0,1 m? jelaskan . Suspend . Konduktor adalah bahan yg bisa menghantarkan listrik , HCl merupakan elektrolit kuat yg bisa menghantarkan listrik dgn baik, sedangkan CH3COOH adalah elektrolit lemah yg kurang baik menghantarkan arus listrik . 0 votes. Thanks 1 . Hasil pencarian yang cocok: Suspend Konduktor adalah bahan yg bisa menghantarkan listrik , HCl merupakan elektrolit kuat yg bisa menghantarkan listrik dgn baik, sedangkan CH3COOH ... ... Top 7: Manakah larutan yang menghantarkan listrik lebih baik ...
Pengarang: apaartidari.com - Peringkat 168 Hasil pencarian yang cocok: Manakah konduktor yang lebih baik? jelaskan a. HCI 0,1 M atau HCI 0,2 Mb. HCI 0,1 M atau CH3COOH 0,1 Mc. HCI 0,1 M atau H2SO4 0,1 M Pengertian ... ... Top 8: Top 10 manakah yang merupakan konduktor 2022 - apaartidari.com
Pengarang: apaartidari.com - Peringkat 142 Hasil pencarian yang cocok: 15 Mar 2022 — Hasil pencarian yang cocok: 28 Okt 2021 — Manakah yang merupakan konduktor yang lebih baik jelaskan jawaban anda a H2SO4 0 1 M atau CH3COOH 0 1 ... ... Top 9: Manakah konduktor yang lebih baik?jelaskan a. HCI 0,1 M atau ...
Pengarang: banksoal.cyou - Peringkat 122 Ringkasan: . halo tolong dibantu dgn cara yaa, terima kasih . . Tuliskanlah reaksi contoh reaksi redoks yang berlangsung cepat dan berlangsung lambatplis tolong di jawab . . c. 1 (2) dan (3) 13. Seorang siswa melakukan pengujian pH air limbah dengan berbagai indikator, data yang diperoleh adalah sebagai berikut. Trayek Ind. … ikator Air Limbah yang Diuji Indikator Perubahan pH А B Warna Merah Metil Merah 4,0-6,3 Kuning Kuning Kuning Bromtimol Kuning 6,0-7,6 Biru Hijau Biru Biru Hasil pencarian yang cocok: 0,2 Mb. HCI 0,1 atau CH3COOH 0,1 Mc. HCI 0,1 atau H2SO4 0,1 MJawabannya C.HCl 0,1 atau H2SO4 0,1 MAlasan karena HCl atau H2S04 termasuk dalam larutan ... ... Top 10: Manakah konduktor yang lebih baik dari larutan berikut ini dan jelaskan ...
Pengarang: barang.live - Peringkat 138 Ringkasan: tjendanayaminp4pa1h . tjendanayaminp4pa1h a. NaCl 0.2 Mb. H2SO4c. HCl 0.2 MSecara umum, daya hantar listrik dipengaruhi oleh jumlah ion-ion yg terlarut dalam larutan tsb. Jumlah ion terlarut dipengaruhi oleh konsentrasi dan jenis elektrolitnya apakah elektrolit kuat (HCl, H2SO4 an HCl) atau elektrolit lemah, terionisasi sebagian (CH3COOH).a. Sdh jelas pengaruh konsentrasi.b. Jumlah ion terlarut asam sulfat lbh besarc. Pengaruh elektrolit kua Hasil pencarian yang cocok: 12 Apr 2018 — Manakah konduktor yang lebih baik dari larutan berikut ini dan jelaskan penyebabnya: a. NaCl 0,1 M dengan NaCl 0,2 M b. HCl 0,2 M dengan ... ... |

Pos Terkait
Periklanan
BERITA TERKINI
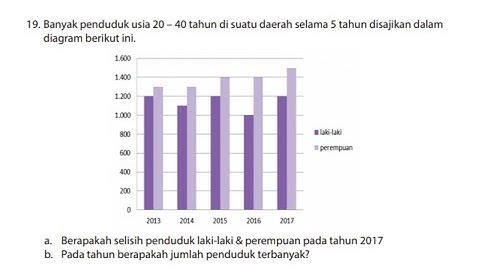
Toplist Popular
#2
#4
#6
#8
Periklanan
Terpopuler
Periklanan
Tentang Kami
Dukungan

Copyright © 2024 idkuu.com Inc.