Elektron valensi adalah elektron dalam atom yang berperan dalam pembentukan ikatan kimia. Pada unsur-unsur golongan utama [IA, IIA, IIIA, hingga VIIIA], elektron valensi adalah elektron yang berada pada kulit elektron terluar. Show Oleh karena itu, kulit elektron terluar sering disebut sebagai kulit valensi. Namun, perlu diperhatikan bahwa tidak semua elektron valensi hanya berada pada kulit terluar. Elektron valensi unsur-unsur golongan transisi dapat berada pada kulit elektron yang lebih dalam dari kulit terluar. Lihat juga materi StudioBelajar.com lainnya: Kesetimbangan Kimia Gas Mulia Konfigurasi ElektronKonfigurasi elektron merupakan susunan persebaran [distribusi] elektron-elektron dalam atom. Elektron hanya dapat berada pada lintasan peredaran elektron tertentu dalam atom, bergantung pada level energinya. Lintasan peredaran elektron ini disebut juga sebagai kulit elektron. Kulit elektron pertama yang terdekat dengan inti atom disebut kulit K, kemudian kulit kedua disebut kulit L, kulit ketiga disebut kulit M, dan seterusnya berurut berdasarkan alfabet. Setiap kulit elektron hanya dapat terisi sejumlah tertentu elektron. Jumlah maksimum elektron yang dapat terisi pada kulit elektron ke-n adalah 2n2, di mana n adalah nomor kulit atau bilangan kuantum utama.
Elektron-elektron akan mengisi kulit-kulit elektron pada atom dimulai dari kulit pertama yang terdekat dengan inti, yakni kulit K yang merupakan level energi yang terendah. Jika kulit K telah terisi penuh dengan 2 elektron, selanjutnya elektron akan mengisi kulit L. Lalu jika kulit L telah terisi penuh dengan 8 elektron, selanjutnya elektron akan mengisi kulit M, N, dan seterusnya secara bertahap. Namun, jumlah maksimum elektron pada kulit terluar [kulit valensi] dari suatu atom adalah 8. Ilustrasi konfigurasi elektron atom Li, B, O, Ne, Na, dan K berdasarkan kulit elektron Untuk atom unsur golongan utama, penentuan konfigurasi elektron berdasarkan nomor atom atau jumlah elektronnya dapat mengikuti aturan sebagai berikut.
Berikut tabel yang menunjukkan konfigurasi elektron dari beberapa unsur berdasarkan kulit elektron. Pada tabel tersebut terlihat konfigurasi elektron atom unsur-unsur transisi seperti Sc, Ti, Cr, Cu, dan Zn. Bila diperhatikan, konfigurasi elektron untuk unsur Sc, Ti, dan Cr tidak mengikuti aturan konfigurasi berdasarkan kulit elektron seperti yang telah dijelaskan di atas. Hal ini dikarenakan penentuan konfigurasi elektron atom unsur golongan transisi hanya dapat didasarkan pada orbital atom. Jadi, untuk atom unsur golongan transisi, aturan penentuan konfigurasi elektronnya lebih kompleks. Penentuan konfigurasi elektron berdasarkan orbital atom akan dibahas dalam bab “Bilangan Kuantum”. Setiap orbital dalam atom akan ditandai dengan satu set nilai bilangan kuantum utama [n], bilangan kuantum azimuth [l], dan bilangan kuantum magnetik [ml] yang khusus. Lalu, setiap orbital maksimum terisi 2 elektron, yang masing-masing memiliki bilangan kuantum spin [ms] tersendiri. Keempat bilangan kuantum tersebut digunakan untuk mendeskripsikan energi elektron, sebagaimana seperti “alamat” elektron dalam sebuah atom untuk menemukan probabilitas keberadaan elektron dalam atom tersebut. Elektron Valensi dan Sistem Periodik UnsurSifat-sifat dari suatu unsur sangat bergantung pada konfigurasi elektronnya, terutama pada jumlah elektron valensinya. Unsur-unsur dengan jumlah elektron valensi yang sama umumnya memiliki kemiripan sifat. Oleh karena sistem periodik unsur disusun berdasarkan kenaikan nomor atom dan kemiripan sifat, terdapat hubungan antara konfigurasi elektron atom unsur dan letak unsur dalam sistem periodik, di mana:
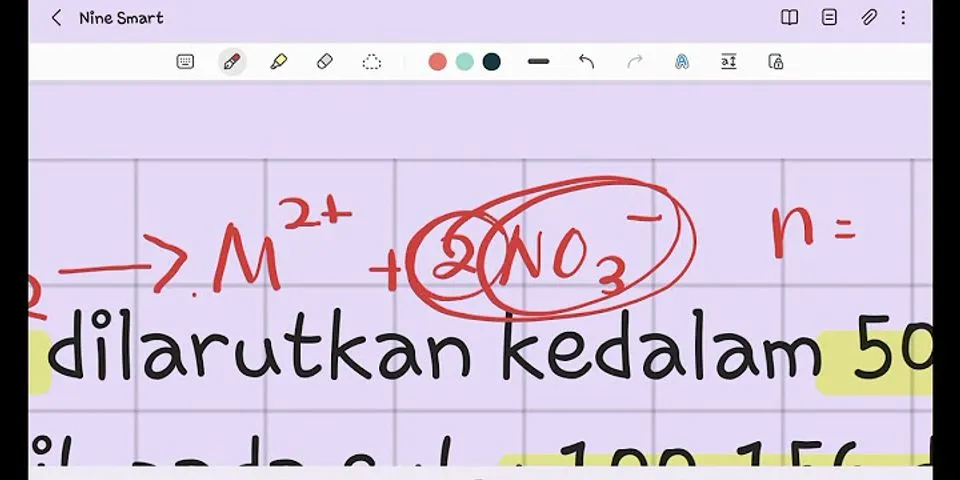
Contoh Soal Elektron Valensi dan PembahasanTentukan konfigurasi elektron dari atom dan ion unsur-unsur berikut. a. Ca [Z = 20] Jawab: a. Ca [Z = 20] menunjukkan bahwa atom Ca memiliki 20 proton dan 20 elektron. 20 elektron atom Ca akan mengisi penuh kulit K [2 e−] dan kulit L [8 e−] sehingga tersisa 20 − [2 + 8] = 10 elektron. Karena jumlah elektron tersisa < 18, maka kulit selanjutnya, yakni kulit M, akan diisi oleh 8 e−. Dengan demikian, tersisa 20 − [2 + 8 + 8] = 2 elektron. Karena jumlah elektron tersisa ≤ 8, maka kulit selanjutnya, yakni kulit N, akan diisi oleh semua elektron yang masih tersisa, yaitu sejumlah 2 elektron. Jadi, konfigurasi elektron atom Ca adalah 20Ca : 2 8 8 2 b. Cs [Z = 55] menunjukkan bahwa atom Cs memiliki 55 proton dan 55 elektron. 55 elektron atom Cs akan mengisi penuh kulit K [2 e−], kulit L [8 e−], dan kulit M [18 e−] sehingga tersisa 55 − [2 + 8 + 18] = 27 elektron. Karena jumlah elektron tersisa < 32, maka kulit selanjutnya, yakni kulit N, akan diisi oleh 18 e−. Dengan demikian, tersisa 20 − [2 + 8 + 18 + 18] = 9 elektron. Karena jumlah elektron tersisa < 18, maka kulit selanjutnya, yakni kulit O, akan diisi oleh 8 e−. Dengan demikian, tersisa 20 − [2 + 8 + 18 + 18 + 8] = 1 elektron. Karena jumlah elektron tersisa ≤ 8, maka kulit selanjutnya, yakni kulit P, akan diisi oleh semua elektron yang masih tersisa, yaitu sejumlah 1 elektron. Jadi, konfigurasi elektron atom Cs adalah 55Cs : 2 8 18 18 8 1 Elektron Valensi – Referensi Earl, Bryan & Wilford, Doug. 2014. Cambridge IGCSE® Chemistry [3rd edition]. London: Hodder Education Purba, Michael. 2006. Kimia 1A untuk SMA Kelas X. Jakarta: Erlangga Spencer, James N., Bodner, George M., & Rickard, Lyman H. 2011. Chemistry: Structure and Dynamics [5th edition]. New Jersey: John Wiley & Sons, Inc. Stacy, Angelica M. 2015. Living by Chemistry [2nd edition]. New York: W.H. Freeman and Company Artikel: Elektron Valensi Kontributor: Nirwan Susianto, S.Si. Alumni Kimia FMIPA UI Materi StudioBelajar.com lainnya:
Konfigurasi elektron merupakan susunan elektron-elektron dalam kulit-kulit atau subkulit-subkulit. Pengisian elektron pada tingkat subkulit akan dibahas di kelas XI. Konfigurasi elektron yang akan dibahas pada bab ini hanya untuk memudahkan dalam penentuan periode dan golongan, khususnya golongan utama [A]. Pengisian elektron dimulai dari tingkat energi [kulit] yang paling rendah yaitu kulit K. Tiap kulit maksimum mampu menampung 2n2 elektron, n adalah nomor kulit. Kulit K [n = 1] maksimum menampung elektron 2 12 = 2. Kulit L [n = 2] maksimum menampung elektron 2 22 = 8. Kulit M [n = 3] maksimum menampung elektron 2 32 = 18. Kulit N [n = 4] maksimum menampung elektron 2 42 = 32. Contoh: 3Li - Kulit K maksimum 2 elektron - Kulit L sisanya 1 - Distribusinya: 2, 1 20Ca - Kulit K maksimum 2 elektron. - Kulit L maksimum 8 elektron. - Kulit M diisi 8 elektron. Jumlah elektron sisa = 20 – [2 + 8] = 10 merupakan jumlah antara 8 [jumlah maksimum kulit L] dan 18 [jumlah maksimum kulit M] maka diisikan 8 elektron. - Kulit N sisanya 2 elektron. - Distribusinya: 2, 8, 8, 2 56Ba - Kulit K maksimum 2 elektron. - Kulit L maksimum 8 elektron. - Kulit M maksimum 18 elektron. - Kulit N diisi 18 elektron. Jumlah elektron sisa = 56 – [2 + 8 + 18] = 28, merupakan jumlah antara 18 [jumlah maksimum kulit M] dan 32 [jumlah maksimum kulit N], maka diisikan 18 elektron. - Kulit O diisi 8 elektron.[Seperti pada kulit M konfigurasi Ca]. - Kulit P sisanya 2 elektron. - Distribusinya: 2, 8, 18, 18, 8, 2 Konfigurasi elektron pada kation dan anion Kation adalah ion positif, terjadi kalau atom unsur melepas elektron. Tabel 2.6 Contoh-contoh konfigurasi elektron pada kation Anion adalah ion negatif, terjadi jika atom netral menangkap elektron. Elektron valensi Elektron valensi adalah banyaknya elektron pada kulit terluar. Tabel 2.8 Contoh-contoh menentukan elektron valensi unsur Suatu cara penulisan yang menunjukkan distribusi elektron dalam orbital-orbital pada kulit utama dan subkulit disebut konfigurasi elektron. Pada penulisan konfigurasi elektron perlu dipertimbangkan tiga aturan [asas], yaitu prinsip Aufbau, asas larangan Pauli, dan kaidah Hund. 1. Prinsip Aufbau Elektron-elektron dalam suatu atom berusaha untuk menempati subkulitsubkulit yang berenergi rendah, kemudian baru ke tingkat energi yang lebih tinggi. Dengan demikian, atom berada pada tingkat energi minimum. Inilah yang disebut prinsip Aufbau. Urutan-urutan tingkat energi ditunjukkan pada gambar 1.11. Jadi, pengisian orbital dimulai dari orbital 1s, 2s, 2p, dan seterusnya. Pada gambar dapat dilihat bahwa subkulit 3d mempunyai energi lebih tinggi daripada subkulit 4s. Oleh karena itu, setelah 3p terisi penuh maka elektron berikutnya akan mengisi subkulit 4s, baru kemudian akan mengisi subkulit 3d. 2. Kaidah Hund Untuk menyatakan distribusi elektron-elektron pada orbital-orbital dalam suatu subkulit, konfigurasi elektron dapat dituliskan dalam bentuk diagram orbital. Suatu orbital dilambangkan dengan strip, sedangkan dua elektron yang menghuni satu orbital dilambangkan dengan dua anak panah yang berlawanan arah. Jika orbital hanya mengandung satu elektron, anak panah dituliskan mengarah ke atas. Dalam kaidah Hund, dikemukakan oleh Friedrich Hund [1894 – 1968] pada tahun 1930, disebutkan bahwa elektron-elektron dalam orbital-orbital suatu subkulit cenderung untuk tidak berpasangan. Elektron-elektron baru berpasangan apabila pada subkulit itu sudah tidak ada lagi orbital kosong. 3. Larangan Pauli Pada tahun 1928, Wolfgang Pauli [1900 – 1958] mengemukakan bahwa tidak ada dua elektron dalam satu atom yang boleh mempunyai keempat bilangan kuantum yang sama. Dua elektron yang mempunyai bilangan kuantum utama, azimuth, dan magnetik yang sama dalam satu orbital, harus mempunyai spin yang berbeda. Kedua elektron tersebut berpasangan. Setiap orbital mampu menampung maksimum dua elektron. Untuk mengimbangi gaya tolak-menolak di antara elektron-elektron tersebut, dua elektron dalam satu orbital selalu berotasi dalam arah yang berlawanan. Subkulit s [1 orbital] maksimum 2 elektron Subkulit p [3 orbital] maksimum 6 elektron Subkulit d [5 orbital] maksimum 10 elektron Subkulit f [7 orbital] maksimum 14 elektron Video yang berhubungan |

Pos Terkait
Periklanan
BERITA TERKINI
Toplist Popular
#2
#4
#6
#8
Periklanan
Terpopuler
Periklanan
Tentang Kami
Dukungan

Copyright © 2024 idkuu.com Inc.